Внутриклеточные рецепторы гормонов. Механизмы вторичных посредников. Внутриклеточные (ядерные) рецепторы, регулирующие экспрессию гена Рецепторы клетки
Внутриклеточные рецепторы - как правило, факторы транскрипции (например, рецепторы w:глюкокортикоидов) или белки, взаимодействующие с факторами транскрипции. Большинство внутриклеточных рецепторов связываются с лигандами в цитоплазме, переходят в активное состояние, транспортируются вместе с лигандом в ядро клетки, там связываются с ДНК и либо индуцируют, либо подавляют экспрессию некоторого гена или группы генов. Особым механизмом действия обладает оксид азота (NO). Проникая через мембрану, этот гормон связывается с растворимой (цитозольной) гуанилатциклазой, которая одновременно является и рецептором оксида азота, и ферментом, который синтезирует вторичный посредник - цГМФ.
Сигнальная функция
Сигнальная функция белков - способность белков служить сигнальными веществами, передавая сигналы между тканями, клетками или организмами. Сигнальную функцию выполняют белки-гормоны. Связывание гормона с рецептором является сигналом, запускающим в клетке физиологические процессы. Гормоны регулируют концентрации веществ в крови и клетках, рост, размножение и другие процессы. Например, инсулин снижает содержание сахара в крови, гормон роста регулирует рост скелета, лептин регулирует аппетит. Клетки могут взаимодействуют друг с другом на расстоянии с помощью сигнальных белков, передаваемых через межклеточное вещество. К таким белкам относятся цитокины, факторы роста и др.
Цитокины - небольшие пептидные информационные молекулы. Они регулируют взаимодействия между клетками, определяют жизнедеятельность клеток, их выживаемость, стимулируют или подавляют рост, дифференциацию, функциональную активность и апоптоз (явление программируемой клеточной смерти), обеспечивают согласованность и упорядоченность действий иммунной, эндокринной и нервной систем. Примером цитокинов может служить фактор некроза опухолей|, который передаёт сигналы воспаления между клетками организма
Регуляторная функция
Регуляторная функция белков ― осуществление белками регуляции процессов в клетке или в организме, что связано с их способностью к приему и передаче информации. Действие регуляторных белков обратимо и, как правило, требует присутствия лиганда. Постоянно открывают все новые и новые регуляторные белки, в настоящее время известна, вероятно, только малая их часть.
Существует несколько разновидностей белков, выполняющих регуляторную функцию:
белки - рецепторы, воспринимающие сигнал (см. раздел "Рецепторная функция)
сигнальные белки - гормоны и другие вещества, осуществляющие межклеточную сигнализацию (многие, хотя и далеко не все, из них является белками или пептидами) (см. раздел «Сигнальная функция»)
регуляторные белки, которые регулируют многие процессы внутри клеток.
Белки регулируют процессы, происходщие внутри клеток, при помощи нескольких механизмов:
взаимодействия с молекулами ДНК (транскрипционные факторы)
при помощи фосфорилирования (протеинкиназы) или дефосфорилирования (протеинфосфатазы) других белков
при помощи взаимодействия с рибосомой или молекулами РНК (факторы регуляции трансляции)
воздействия на процесс удаления интронов (факторы регуляции сплайсинга)
Белки-регуляторы транскрипции
Транскрипционный фактор - это белок, который, попадая в ядро клетки, регулирует транскрипцию ДНК, то есть синтез мРНК по матрице ДНК. Некоторые транскрипционные факторы изменяют структуру хроматина, делая его более доступным для РНК-полимераз. Существуют различные вспомогательные транскрипционные факторы, которые создают нужную конформацию ДНК для последующего действия других транскрипционных факторов. Еще одна группа транскрипционных факторов - это те факторы, которые не связываются непосредственно с молекулами ДНК, а объединяются в более сложные комплексы с помощью белок-белковых взаимодействий.
Стероидные и тиреоидные гормоны связываются с рецепторами внутри клетки и регулируют скорость транскрипции специфических генов.
В отсутствие гормона внутриклеточные рецепторы связаны обычно с другими белками в цитозоле или ядре. Например, рецепторы глюкокортикоидов образуют в цитозоле комплекс с шапероном, что препятствует связыванию рецептора с молекулой ДНК.
Взаимодействие гормона с центром связывания на С-концевом участке полипептидной цепи рецептора вызывает конформационные изменения и освобождение рецептора от шаперона. Происходит объединение 2 молекул рецептора с образованием гомодимера. Димер рецептора узнаёт специфическую последовательность нуклеотидов, которая расположена в промоторной области гена. Взаимодействие со специфическим участком ДНК HRE (от англ, hormone response element, элемент, реагирующий на воздействие гормона) обеспечивает центральный домен рецептора
Передача гормональных сигналов через внутриклеточные рецепторы (рецепторы стероидных гормонов могут находиться в цитоплазме и ядре).
Центральный домен рецептора содержит аминокислотную последовательность, образующую 2 "цинковых пальца". В каждом "цинковом пальце" атом цинка связан с 4 остатками цистеина.
В структуре одного "цинкового пальца" имеется последовательность аминокислот, отвечающая за связывание с ДНК, а второй "цинковый палец" содержит последовательность аминокислот, участвующую в димеризации рецепторов. Взаимодействие комплекса гормон-рецептор с определённой последовательностью нуклеотидрв в промоторной части ДНК приводит к активации транскрипции.
Рецепторы тиреоидных гормонов всегда связаны с ДНК . В отсутствие гормонов соответствующие рецепторы ингибируют экспрессию генов. Напротив, взаимодействие с гормоном превращает их в активаторы транскрипции.

Регуляция активности рецептора стероидных гормонов. 1 - в отсутствие гормона рецептор через гормонсвязывающий домен образует комплекс с шапероном, что препятствует связыванию рецептора с молекулой ДНК; 2 - в присутствии гормона рецептор освобождается от шаперона, образуется димер рецептора, который присоединяется к молекуле ДНК и вызывает активацию транскрипции.

Структура центрального домена стероидного гормона. 1 - аминокислотные остатки, участвующие в связывании ДНК; 2 - область димеризации. Центральный ДНК-связывающий домен содержит 2 "цинковых пальца". Атомы цинка связаны с аминокислотной последовательностью через остатки цистеина. Функциональные области 1 и 2 отвечают соответственно за связывание ДНК и димеризацию рецептора.
3. Передача сигналов через рецепторы, сопряжённые с ионными каналами
Рецепторы, сопряжённые с ионными каналами, являются интегральными мембранными белками, состоящими из нескольких субъединиц. Они действуют одновременно как ионные каналы и как рецепторы, которые способны специфически связывать с внешней стороны эффектор, изменяющий их ионную проводимость. Эффекторами такого типа могут быть гормоны и нейромедиаторы.
Известны рецепторы для ряда гормонов, ассоциированных с ионными каналами, и большинства медиаторов, среди которых наиболее изучен рецептор ацетилхолина. Рецептор ацетилхолина состоит из пяти цилиндрообразных субъединиц, расположенных в мембране параллельно друг другу: α 2 , β, γ, δ. Между ними вдоль оси цилиндров находится заполненный молекулами воды канал. Каждая субъединица рецептора состоит из большого количества гидрофобных аминокислотных остатков. Кроме этого, все субъединицы содержат один спирализованный трансмембранный фрагмент, аминокислотные радикалы которого (полярные незаряженные аминокислотные остатки, в основном серии и треонин) выстилают центральный канал рецептора изнутри. В средней части субъединиц, обращённой к каналу, локализованы остатки лейцина. В присутствии ацетилхолина боковые взаимодействия между субъединицами поддерживают канал в открытом состоянии и создают возможность для транспорта ионов. В отсутствие ацетилхолина в результате изменения ориентации субъединиц относительно друг друга канал закрывается, так как выступающие внутрь канала остатки лейцина образуют плотное гидрофобное кольцо, блокируя движение гидратированных ионов в этой области:

Схема строения рецептора ацетилхолина. А - закрытый канал рецептора в отсутствие ацетилхолина; Б - открытый канал рецептора в присутствии ацетилхолина. Трансмембранные спирализованные участки всех 5 субъединиц содержат полярные незаряженные радикалы аминокислот; гидрофобные остатки лейцина (Л), локализованные в середине каждого спирализованного гидрофильного участка, выступают в центральную часть канала и препятствуют движению ионов.
ГОРМОНЫ МОЗГОВОГО ВЕЩЕСТВА НАДПОЧЕЧНИКОВ, ЩИТОВИДНОЙ, ПАРАЩИТОВИДНОЙ И ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗ.
ГОРМОНЫ МОЗГОВОГО ВЕЩЕСТВА НАДПОЧЕЧНИКОВ
Катехоламины
Строение
Представляют собой производные аминокислоты тирозина.
Синтез
Осуществляется в клетках мозгового слоя надпочечников (80% всего адреналина), синтез норадреналина (80%) происходит также в нервных синапсах.

Реакции синтеза катехоламинов
Регуляция синтеза и секреции
Активируют : стимуляция чревного нерва, стресс.
Уменьшают : гормоны щитовидной железы.
Механизм действия
Механизм действия гормонов разный в зависимости от рецептора. Конечный эффект гормонов зависит от преобладания типа рецепторов на клетке и концентрации гормона в крови. Например, в жировой ткани при низких концентрациях адреналина более активны α 2 -адренорецепторы, при повышенных концентрациях (стресс) – стимулируются β 1 -, β 2 -, β 3 -адренорецепторы.
Аденилатциклазный механизм
при задействовании α 2 -адренорецепторов аденилатциклаза ингибируется,
при задействовании β 1 - и β 2 -адренорецепторов аденилатциклаза активируется.
Кальций-фосфолипидный механизм
при возбуждении α 1 -адренорецепторов.
Мишени и эффекты
При возбуждении α 1 -адренорецепторов (печень, сердечно-сосудистая и мочеполовая системы):
активация гликогенолиза ,
сокращение гладких мышц кровеносных сосудов и мочеполовой системы.
При возбуждении α 2 -адренорецепторов (жировая ткань, поджелудочная железа, почки):
подавление липолиза (уменьшение стимуляции ТАГ-липазы),
подавление секреции инсулина и секреции ренина .
При возбуждении β 1 -адренорецепторов (есть во всех тканях):
активация липолиза ,
увеличение силы и частоты сокращений миокарда.
При возбуждении β 2 -адренорецепторов (есть во всех тканях):
стимуляция гликогенолиза в печени и мышцах, и глюконеогенеза в печени,
расслабление гладких мышц бронхов, кровеносных сосудов, мочеполовой системы и желудочно-кишечного тракта.
В целом катехоламины отвечают за биохимические реакции адаптации к острым стрессам, связанным с мышечной активностью – "борьба или бегство ":
усиление липолиза и продукция жирных кислот в жировой ткани для мышечной активности,
гипергликемия за счет глюконеогенеза и гликогенолиза в печени для повышения устойчивости ЦНС,
стимуляция гликогенолиза в мышцах,
активация протеолиза в лимфоидной ткани для обеспечения глюконеогенеза субстратом (аминокислотами),
снижение анаболических процессов через уменьшение секреции инсулина.
Адаптация также прослеживается в физиологических реакциях:
мозг – усиление кровотока и стимуляция обмена глюкозы,
мышцы – усиление сократимости,
сердечно-сосудистая система – увеличение силы и частоты сокращений миокарда,
легкие – расширение бронхов, улучшение вентиляции и потребления кислорода,
кожа – снижение кровотока.
Патология
Гиперфункция
Опухоль мозгового вещества надпочечников феохромоцитома . Ее диагностируют только после проявления гипертензии и лечат удалением опухоли.
Фармакодинамика - раздел клинической фармакологии, изучающий механизмы действия, характер, силу и длительность фармакологических эффектов ЛС, используемых в клинической практике.
Пути воздействия ЛС на организм человека
Большинство ЛС, связываясь с рецепторами или другими молекулами-мишенями, образуют комплекс «ЛС-рецептор», при этом происходит запуск определённых физиологических или биохимических процессов (или количественное их изменение) в организме человека. В таком случае говорят о прямом действии ЛС. Структура ЛС прямого действия, как правило, аналогична строению эндогенного медиатора (однако при взаимодействии ЛС и медиатора с рецептором нередко регистрируют различные эффекты).
Группы лекарственных средств
Для удобства примем величину эффекта эндогенного медиатора, связывающегося с рецептором, равной единице. Существует классификация ЛС, созданная на основе данного предположения.
Агонисты - ЛС, связывающиеся с теми же рецепторами, что и эндогенные медиаторы. Агонисты производят эффект, равный единице (или больше единицы).
Антагонисты - ЛС, соединяющиеся с теми же рецепторами, что и эндогенные медиаторы; не оказывают никакого действия (в таком случае говорят о «нулевом эффекте»).
Частичные агонисты или агонисты-антагонисты - ЛС, связывающиеся с тем же рецепторами, что и эндогенные медиаторы. Эффект, регистрируемый при взаимодействии частичного агониста с рецептором, всегда больше нуля, но меньше единицы.
Все естественные медиаторы - агонисты своих рецепторов.
Нередко отмечают опосредованное действие, заключающееся в изменении активности молекул-мишеней под влиянием ЛС (воздействует таким образом на различные метаболические процессы).
Молекулы-мишени ЛС
ЛС, связываясь с молекулой-мишенью, принадлежащей клетке (или расположенной внеклеточно), модифицирует её функциональный статус, приводя к усилению, ослаблению или стабилизации филогенетически детерминированных реакций организма.
Рецепторы.
- Мембранные (рецепторы I, II и III типов).
- Внутриклеточные (рецепторы IV типа).
Нерецепторные молекулы-мишени цитоплазматической мембраны.
- Цитоплазматические ионные каналы.
- Неспецифические белки и липиды цитоплазматической мембраны.
Иммуноглобулиновые молекулы-мишени.
Ферменты.
Неорганические соединения (например, соляная кислота и металлы).
Молекулы-мишени обладают комплементарностью к эндогенным медиаторам и соответствующим ЛС, заключающейся в определён- ном пространственном расположении ионных, гидрофобных, нуклеофильных или электрофильных функциональных групп. Многие ЛС (антигистаминные препараты I поколения, трициклические антидепрессанты и некоторые другие) могут связываться с морфологически близкими, но функционально отличающимися молекуламимишенями.
Виды связей лекарственных средств с молекулами-мишенями
Самые слабые связи между ЛС и молекулой-мишенью - ван-дерваальсовые связи, обусловленные дипольными взаимодействиями; наиболее часто определяют специфичность взаимодействия препарата и молекулы-мишени. Гидрофобные связи, характерные для ЛС стероидной структуры, более сильные. Гидрофобные свойства глюкокортикостероидных гормонов и липидного бислоя плазматической мембраны позволяют таким ЛС легко проникать через цитоплазматическую и внутриклеточную мембраны внутрь клетки и ядра к своим рецепторам. Ещё более сильные водородные связи образуются между атомами водорода и кислорода соседних молекул. Водородные и вандер-ваальсовые связи возникают при наличии комплементарности ЛС и молекул-мишеней (например, между агонистом или антагонистом и рецептором). Их сила достаточна для образования комплекса ЛС-ре- цептор.
Наиболее сильные связи - ионные и ковалентные. Ионные связи формируются, как правило, между ионами металлов и остатками сильных кислот (антациды) при поляризации. При соединении ЛС и рецептора возникают необратимые ковалентные связи. Антагонис-
ты необратимого действия связываются с рецепторами ковалентно. Большое значение имеет образование координационных ковалентных связей. Стабильные хелатные комплексы (например, соединение ЛС и его антидота - унитиола* с дигоксином) - простая модель координационной ковалентной связи. При формировании ковалентной связи обычно происходит «выключение» молекулы-мишени. Этим объясняют формирование стойкого фармакологического эффекта (антиагрегантный эффект ацетилсалициловой кислоты - результат её необратимого взаимодействия с циклооксигеназой тромбоцитов), а также развитие некоторых побочных эффектов (ульцерогенное влияние ацетилсалициловой кислоты - следствие образования неразрывной связи между данным лекарственным веществом и циклооксигеназой клеток слизистой оболочки желудка).
Нерецепторные молекулы-мишени плазматической мембраны
Препараты, используемые для ингаляционного наркоза - пример ЛС, связывающихся с нерецепторными молекулами-мишенями плазматической мембраны. Средства для ингаляционного наркоза (галотан, энфлуран*) неспецифически соединяются с белками (ионными каналами) и липидами плазматической мембраны центральных нейронов. Существует мнение, что в результате такого связывания препараты нарушают проводимость ионных каналов (в том числе натриевых), приводя к увеличению порога потенциала действия и уменьшению частоты его возникновения. Средства для ингаляционного наркоза, соединяясь с элементами мембран центральных нейронов, вызывают обратимое изменение их упорядоченной структуры. Данный факт под- тверждён экспериментальными исследованиями: анестезированные животные быстро выходят из состояния общего наркоза при помещении их в гипербарическую камеру, где происходит восстановление мембранных нарушений.
Нерецепторные плазматические структуры (потенциал-зависимые натриевые каналы) также выполняют функции молекул-мишеней местных анестетиков. ЛС, связываясь с потенциал-зависимыми натриевыми каналами аксонов и центральных нейронов, блокируют каналы, и, таким образом, нарушают их проводимость для ионов натрия. В результате происходит нарушение деполяризации клетки. Терапевтические дозы местных анестетиков блокируют проводимость периферических нервов, а токсические их количества угнетают и центральные нейроны.
У некоторых ЛС отсутствуют свои молекулы-мишени. Однако такие препараты выполняют функцию субстратов для многих метаболических реакций. Существует понятие «субстратного действия» ЛС:
их применяют для восполнения недостатка различных необходимых организму субстратов (например, аминокислоты, витамины, витаминно-минеральные комплексы и глюкоза).
Рецепторы
Рецепторы - белковые макромолекулы или полипептиды, нередко соединённые с полисахаридными ветвями и остатками жирных кислот (гликопротеины, липопротеины). Каждое ЛС можно сравнить с ключом, подходящим к своему замку - специфическому рецептору данного вещества. Однако только часть молекулы рецептора, называемая сайтом связывания, представляет «замочную скважину». ЛС, соединяясь с рецептором, потенцирует формирование в нём конформационных изменений, приводящих к функциональным изменениям других частей рецепторной молекулы.
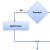
Типичная схема работы рецепторов включает четыре этапа.
Связывание ЛС с рецептором, расположенным на клеточной поверхности (или внутриклеточно).
Образование комплекса ЛС-рецептор и, следовательно, изменение конформации рецептора.
Передача сигнала от комплекса ЛС-рецептор к клетке через различные эффекторные системы, многократно усиливающие и интерпретирующие этот сигнал.
Клеточный ответ (быстрый и отсроченный).
Выделяют четыре фармакологически значимых типа рецепторов
Рецепторы - ионные каналы.
Рецепторы, сопряжённые с G-белками.
Рецепторы, обладающие тирозинкиназной активностью.
Внутриклеточные рецепторы. Мембранные рецепторы
Рецепторы I, II и III типов встроены в плазматическую мембрану - трансмембранные белки по отношению к клеточной мембране. Рецепторы IV типа расположены внутриклеточно - в ядре и других субклеточных структурах. Кроме того, выделяют иммуноглобулиновые рецепторы, представляющие гликопротеиновые макромолекулы.
Рецепторы I типа имеют вид и строение ионных каналов, обладают сайтами связывания со специфическим ЛС или медиатором, индуцирующим открытие ионного канала, образованного рецептором. Один из представителей I типа рецепторов - N-холинорецептор - гликопротеин, состоящий из пяти трансмембранных полипептидных субъединиц. Выделяют четыре вида субъединиц - α, β, γ и δ тип. В состав гликопротеина входят по одной субъединице β, γ и δ типа и
две α субъединицы. Трансмембранные полипептидные субъединицы имеют вид цилиндров, пронизывающих мембрану и окружающих узкий канал. Каждый тип субъединиц кодирует собственный ген (однако гены обладают значительной гомологией). Участки связывания ацетилхолина локализуются на «внеклеточных концах» α-субъединиц. При связывании ЛС с этими участками наблюдают конформационные изменения, приводящие к расширению канала и облегчению проводимости ионов натрия, а следовательно, к деполяризации клетки.
К I типу рецепторов, кроме N-холинорецептора, относят также ГАМК А -рецептор, глициновые и глутаматные рецепторы.
Рецепторы, сопряжённые с G-белками (II тип) - самая многочисленная группа рецепторов, обнаруженных в организме человека; выполняют важные функции. С рецепторами II типа связываются большинство нейромедиаторов, гормонов и ЛС. К наиболее распро- странённым клеточным рецепторам этого типа относят вазопрессиновые и ангиотензиновые, α-адренорецепторы, β-адренорецепторы и м-холинорецепторы, опиатные и дофаминовые, аденозиновые, гистаминовые и многие другие рецепторы. Все вышеперечисленные рецепторы - мишени ЛС, составляющих обширные фармакологические группы.
Каждый рецептор второго типа представляет полипептидную цепь с N-концом (расположен во внеклеточной среде) и С-концом (локализован в цитоплазме). При этом полипептидная цепь рецептора семь раз пронизывает плазматическую мембрану клетки (имеет семь трансмембранных сегментов). Таким образом, структуру рецептора II типа можно сравнить с нитью, поочерёдно прошивающей ткань с обеих сторон семь раз. Специфичность различных рецепторов второго типа зависит не только от аминокислотной последовательности, но и от длины и соотношения «петель», выпячивающихся наружу и внутрь клетки.
Рецепторы второго типа образуют комплексы с мембранными G-белками. G-белки состоят из трёх субъединиц: α, β и γ. После связывания рецептора с ЛС образуется комплекс ЛС-рецептор. Затем в рецепторе происходят конформационные изменения. G-белок, связываясь одной или двумя субъединицами со своими «мишенями», активирует или ингибирует их. Аденилатциклаза, фосфолипаза С, ионные каналы, циклический гуанозинмонофосфат (цГМФ)-фосфодиэстераза - мишени G-белка. Как правило, активированные ферменты передают и усиливают «сигнал» через системы вторичных посредников.
Рецепторы с тирозинкиназной активностью
Рецепторы с тирозинкиназной активностью (III тип) - рецепторы пептидных гормонов, регулирующих рост, дифференцировку и
развитие. К пептидным гормонам относят, например, инсулин, эпидермальный фактор роста, фактор роста тромбоцитов. Как правило, связывание рецептора с гормоном активирует тирозиновую протеинкиназу, представляющую цитоплазматическую часть (домен) рецептора. Мишень протеинкиназы - рецептор, обладающий способностью к аутофосфорилированию. Каждый полипептидный рецептор имеет один трансмембранный сегмент (домен).
Однако, как показали исследования, не тирозиновая протеинкиназа, а гуанилатциклаза, катализирующая образование вторичного посредника цГМФ, выполняет функции цитоплазматического домена рецептора предсердного натрийуретического пептида.
Внутриклеточные рецепторы
К внутриклеточным рецепторам (IV тип) относят рецепторы глюкокортикостероидных и тиреоидных гормонов, а также рецепторы ретиноидов и витамина D. В состав группы внутриклеточных рецепторов входят рецепторы, не связанные с плазматической мембраной, локализованные внутри ядра клетки (это главное отличие).
Внутриклеточные рецепторы представляют растворимые ДНК-связывающие белки, регулирующие транскрипцию определённых генов. Каждый рецептор IV типа состоит из трёх доменов - гормон-связывающего, центрального и N-терминального (домен N-конца молекулы рецептора). Эти рецепторы качественно и количественно регулируют уровень транскрипции определённого «набора» генов, специфичного для каждого рецептора, а также вызывают модификацию биохимического и функционального статуса клетки и её метаболических процессов.
Эффекторные системы рецепторов
Существуют различные способы передачи сигналов, формирующихся в процессе функционирования рецепторов, клетке. Путь передачи сигнала зависит от типа рецептора (табл. 2-1).
Главные вторичные посредники - циклический аденозинмонофосфат (цАМФ), ионы кальция, инозитолтрифосфат и диацилглицерол.
Иммуноглобулины (иммуноглобулиновые рецепторы)
С помощью иммуноглобулиновых рецепторов клетки имеют возможность «узнавать» друг друга или антигены. В результате взаимодействия рецепторов происходит адгезия клетки с клеткой или клетки с антигеном. К рецепторам этого типа относят и антитела, свободно циркулирующие во внеклеточных жидкостях и не связанные с клеточными структурами. Антитела, «маркируя» антигены для последующего фагоцитоза, отвечают за развитие гуморального иммунитета.
Таблица 2-1. Эффекторные системы рецепторов
Тип рецептора Пример рецептора Способы передачи сигналов
К типу иммуноглобулинов принадлежат рецепторы, выполняющие функцию «сигнализации» при формировании различных видов и фаз иммунного ответа и иммунной памяти.
Основные представители рецепторов иммуноглобулинового типа (суперсемейства).
Антитела - иммуноглобулины (Ig).
Т-клеточные рецепторы.
Гликопротеины МНС I и МНС II (Major Histocompatibility Complex - главный комплекс гистосовместимости).
Гликопротеины клеточной адгезии (например, CD2, CD4 и CD8).
Некоторые полипептидные цепи комплекса CD3, ассоциированного с Т-клеточными рецепторами.
Fc-рецепторы, расположенные на различных типах лейкоцитов (лимфоциты, макрофаги, нейтрофилы).
Функциональная и морфологическая обособленность иммуноглобулиновых рецепторов позволяет выделить их в отдельный тип.
Ферменты
Многие ЛС, связываясь с ферментами, обратимо или необратимо ингибируют или активируют их. Так, антихолинэстеразные средства усиливают действие ацетилхолина, блокируя расщепляющий его фермент - ацетилхолинэстеразу. Ингибиторы карбоангидразы - группа диуретиков, опосредованно (под влиянием карбоангидразы) уменьшающих реабсорбцию ионов натрия в проксимальных канальцах. НПВС - ингибиторы циклооксигеназы. Однако ацетилсалициловая кислота, в отличие от других НПВС, необратимо блокирует циклооксигеназу, ацетилируя остатки серина (аминокислота) в молекуле фермента. Существует два поколения ингибиторов моноаминоксидазы (МАО). Ингибиторы МАО - ЛС, относящиеся к группе антидепрессантов. Ингибиторы МАО первого поколения (например, фенелзин и изокарбоксазид) необратимо блокируют фермент, окисляющий такие моноамины, как, норадреналин* и серотонин (их недостаток обнаруживают при депрессии). Новое поколение ингибиторов МАО (например, моклобемид) обратимо ингибирует фермент; при этом отмечают меньшую выраженность побочных эффектов (в частности, «тираминового» синдрома).
Неорганические соединения
Существуют ЛС, направленно нейтрализующие или связывающие активные формы различных неорганических соединений. Так, антациды нейтрализуют избыток соляной кислоты желудочного сока, умень-
шая её повреждающее действие на слизистую оболочку желудка и двенадцатиперстной кишки.
Хелатообразующие вещества (комплексоны), соединяясь с опре- делёнными металлами, образуют химически инертные комплексные соединения. Этот эффект используют при лечении отравлений, вызванных приёмом внутрь (или ингаляционно) веществ, содержащих различные металлы (мышьяк, свинец, железо, медь).
Молекулы-мишени, расположенные на чужеродных организмах
Механизмы действия антибактериальных, антипротозойных, антигельминтозных, противогрибковых и противовирусных ЛС очень разнообразны. Приём антибактериальных препаратов, как правило, приводит к нарушению различных этапов синтеза клеточной стенки бактерий (например, к синтезу дефектных белков или РНК в бактериальной клетке) или изменению других механизмов поддержания жизнедеятельности микроорганизма. Подавление или эрадикация возбудителя инфекции - главная цель лечения.
Механизм бактерицидного действия β-лактамных антибиотиков, гликопептидов и изониазида - блокада различных этапов синтеза клеточной стенки микроорганизмов. Все β-лактамные антибиотики (пенициллины, цефалоспорины, карбапенемы и монобактамы) обладают сходным принципом действия. Пенициллины производят бактерицидный эффект, связываясь с пенициллинсвязывающими белками бактерий (выполняют функции ферментов на завершающем этапе синтеза основного компонента клеточной стенки бактерий - пептидогликана). Общность механизма действия β-лактамных антибиотиков заключается в создании препятствий для образования связей между полимерными цепями пептидогликанов с помощью пентаглициновых мостиков (часть структуры антибактериальных препаратов напоминает D-аланил-D-аланин-пептидную цепь клеточной стенки бактерий). Гликопептиды (ванкомицин и тейкопланин*) нарушают синтез клеточной стенки другим способом. Так, ванкомицин оказывает бактерицидное действие, соединяясь со свободной карбоксильной группой пентапептида; таким образом, возникает пространственное препятст-
вие элонгации (удлинения) пептидогликанового хвоста. Изониазид (противотуберкулёзное ЛС) ингибирует синтез миколевых кислот - структурного компонента микобактериальной клеточной стенки.
Механизм бактерицидного действия полимиксинов состоит в нарушении целостности цитоплазматической мембраны бактерий.
Аминогликозиды, тетрациклины, макролиды и левомицетин* угнетают синтез белка бактериальных клеток. Рибосомы бактерий (50S- субъединицы и 30S-субъединицы) и рибосомы человека (6OS-субъеди- ницы и 40S-субъединицы) имеют различную структуру. Этим объясняют избирательное влияние названных групп лекарственных веществ на микроорганизмы. Аминогликозиды и тетрациклины соединяются с 30S-субъединицей рибосомы и ингибируют связывание аминоацилтРНК с А-участком этой тРНК. Кроме того, аминогликозиды нарушают процессы считывания мРНК, блокируя синтез белка. Левомицетин * изменяет процесс транспептидации (перенос растущей аминокислотной цепи на рибосоме с Р-участка на А-участок к вновь приносимым тРНК аминокислотам). Макролиды связываются с 50S-субъединицей рибосомы и ингибируют процесс транслокации (перенос аминокислотной цепи с А-участка на Р-участок).
Хинолоны и фторхинолоны угнетают ДНК-гиразы (топоизомеразу II и топоизомеразу IV) - ферменты, способствующие скручиванию бактериальной ДНК в спираль, необходимую для нормального её функционирования.
Сульфаниламиды ингибируют дигидроптероатсинтетазу, тем самым блокируя синтез предшественников пуринов и пиримидинов (дигидроптеровой и дигидрофолиевой кислот), необходимых для построения ДНК и РНК. Триметоприм угнетает дигидрофолатредуктазу (сродство к бактериальному ферменту очень высоко), нарушая образование тетрагидрофолиевой кислоты (предшественника пуринов и пиримидинов) из дигидрофолиевой. Итак, сульфаниламиды и триметоприм действуют в синергизме, блокируя разные стадии одного процесса - синтеза пуринов и пиримидинов.
5-Нитроимидазолы (метронидазол, тинидазол) оказывают избирательное бактерицидное действие в отношении бактерий, ферментные системы которых способны восстанавливать нитрогруппу. Активные восстановленные формы этих ЛС, нарушая репликацию ДНК и синтез белка, ингибируют тканевое дыхание.
Рифампицин (противотуберкулёзный препарат) специфически угнетает синтез РНК.
Противогрибковые и противовирусные средства обладают некоторым сходством механизмов действия. Производные имидазола и триазола ингибируют синтез эргостерола - главного структурного компо-
нента грибковой клеточной стенки, а полиеновые антибактериальные препараты (амфотерицин, нистатин) связываются с ним. Флуцитозин (противогрибковое ЛС) блокирует синтез грибковой ДНК. Многие противовирусные ЛС (например, ацикловир, идоксуридин, зидовудин - аналоги нуклеозидов) также угнетают синтез вирусных ДНК и
N-холинорецепторы нервно-мышечных синапсов гельминтов - молекулы-мишени таких противогельминтных ЛС, как, пирантел и левамизол. Стимуляция данных рецепторов вызывает тотальный спастический паралич.
Характер, сила и длительность действия ЛС
Длительность, силу и способ взаимодействия ЛС и молекулы-мишени характеризует фармакологический ответ (как правило, обусловлен прямым действием препарата, реже - изменением сопряжённой системы, и только в единичных случаях регистрируют рефлекторный фармакологический ответ).
Основным действием ЛС считают эффект вещества, используемый при лечении данного больного. Другие фармакологические эффекты рассматриваемого ЛС называют второстепенными (или неосновными). Функциональные нарушения, вызванные приёмом препарата, рассматривают как нежелательные реакции (см. главу 4 «Побочные эффекты лекарственных средств»). Один и тот же эффект в одном случае может быть основным, а в другом - второстепенным.
Выделяют генерализованное или локальное (местное) действия ЛС. Местные эффекты наблюдают при использовании мазей, присыпок или ЛС, принимаемых внутрь, не всасывающихся в ЖКТ, либо, наоборот, хорошо всасывающихся, но концентрирующихся в одном органе. В большинстве случаев при проникновении ЛС в биологические жидкости организма его фармакологический эффект может сформироваться в любой точке организма.
Способность многих ЛС воздействовать при монотерапии на различные уровни регуляции и процессы клеточного метаболизма одновременно в нескольких функциональных системах или органах доказывает полиморфизм их фармакологического эффекта. С другой стороны, столь большое многообразие мишеней на всех уровнях регуляции объясняет одинаковый фармакологический эффект ЛС, имеющих различную химическую структуру.
Хаотическое движение молекул позволяет ЛС оказаться вблизи оп- ределённого участка (при высоком аффинитете к рецепторам); при этом необходимого эффекта достигают даже при назначении низких концентраций ЛС. При увеличении концентрации молекул ЛС,
они вступают в реакцию с активными центрами других рецепторов (к которым у них меньший аффинитет); в результате возрастает число фармакологических эффектов, а также исчезает их селективность. Например, β 1 -адреноблокаторы в небольших дозах ингибируют только β 1 -адренорецепторы. Однако при увеличении дозы β 1 -адреноблокаторов, их селективность исчезает, при этом отмечают блокаду всех β-адренорецепторов. Подобную картину наблюдают и при назначении β-адреномиметиков. Таким образом, при увеличении дозы ЛС наряду с некоторым усилением клинического эффекта всегда регистрируют, и значительно, увеличение количества побочных эффектов.
Состояние молекулы-мишени (как в основной, так и в сопряжён- ной системе) необходимо учитывать при прогнозировании и оценке эффективности действия ЛС. Нередко преобладание побочных эффектов над основным действием обусловлено нарушением физиологического баланса вследствие характера заболевания или индивидуальных особенностей пациента.
Более того, сами ЛС могут изменять чувствительность молекул-мишеней, варьируя скорости их синтеза или деградации или индуцируя формирование различных модификаций мишеней под действием внутриклеточных факторов, - всё это приводит к изменению фармакологического ответа.
По фармакологическим эффектам ЛС можно разделить на две группы - вещества, обладающие специфическим и неспецифическим действием. К ЛС неспецифического действия относят препараты, вызывающие развитие широкого спектра фармакологических эффектов путём влияния на различные системы биологического обеспечения. В эту группу ЛС входят, в первую очередь, субстратные вещества: витаминные комплексы, глюкоза и аминокислоты, макроэлементы и микроэлементы, а также растительные адаптогены (например, женьшень и элеутерококк). В связи с отсутствием чётких границ, определяющих основной фармакологический эффект данных ЛС, их назначают большому количеству пациентов при разных заболеваниях.
Если ЛС действует (как агонист или антагонист) на рецепторный аппарат определённых систем, его влияние рассматривают как специфическое. К этой группе ЛС относят антагонисты и агонисты различных подтипов адренорецепторов, холинорецепторов и т.д. Органное расположение рецепторов не влияет на эффект, производимый препаратами специфического действия. Поэтому, несмотря на специфичность действия данных ЛС, регистрируют различные фармакологические ответы. Так, ацетилхолин вызывает сокращение гладких мышц бронхов, пищеварительного тракта, увеличивает секрецию слюнных желёз. Атропин производит противоположный эффект. Избиратель-
ность или селективность действия ЛС отмечают только при изменении активности системы только в определённой её части или в одном органе. Например, пропранолол блокирует все β-адренорецепторы симпатоадреналовой системы. Атенолол - селективный β 1 -адреноблокатор - блокирует только β 1 -адренорецепторы сердца и не влияет на β 2 -адренорецепторы бронхов (при использовании небольших доз). Сальбутамол избирательно стимулирует β 2 -адренорецепторы бронхов, оказывая незначительное действие на β 1 -адренорецепторы сердца.
Избирательность (селективность) действия ЛС - способность вещества накапливаться в ткани (зависит от физико-химических свойств ЛС) и производить требуемый эффект. Избирательность обусловлена также сродством к рассматриваемому морфологическому звену (с учё- том строения клеточной мембраны, особенностей клеточного метаболизма и т.д.). Большие дозы селективно действующих ЛС чаще всего оказывают влияние на всю систему, но вызывают фармакологический ответ, соответствующий специфическому действию ЛС.
Если основная масса рецепторов взаимодействует с ЛС, то отмечают быстрое наступление фармакологического эффекта и его большую выраженность. Процесс происходит только при высоком аффинитете ЛС (его молекула может иметь строение, сходное со структурой естественного агониста). Активность ЛС и длительность его действия в большинстве случаев пропорциональны скорости образования и диссоциации комплекса с рецептором. При повторном введении ЛС иногда регистрируют снижение эффекта (тахифилаксию), т.к. не все рецепторы освободились от предыдущей дозы препарата. Уменьшение выраженности эффекта происходит и в случае истощения рецепторов.
Реакции, регистрируемые при введении лекарственных средств
Ожидаемый фармакологический ответ.
Гиперреактивность - повышенная чувствительность организма к используемому ЛС. Например, при сенсибилизации организма пенициллинами повторное их введение может привести к возникновению реакции гиперчувствительности немедленного типа или даже к развитию анафилактического шока.
Толерантность - снижение чувствительности к применяемому ЛС. Например, при бесконтрольном и длительном приеме β 2 -адреномиметиков, толерантность к ним возрастает, а фармакологический эффект уменьшается.
Идиосинкразия - индивидуальная чрезмерная чувствительность (непереносимость) к данному препарату. Например, причиной идиосинкразии может быть генетически обусловленное отсутс-
твие ферментов, метаболизирующих данное вещество (см. главу 7 «Клиническая фармакогенетика»).
Тахифилаксия - быстро развивающаяся толерантность. К некоторым ЛС, например к нитратам (при непрерывном и длительном их применении), толерантность развивается особенно быстро; при этом препарат заменяют или увеличивают его дозу.
Оценивая время действия ЛС, необходимо выделять латентный период, максимальное действие, время удержания эффекта и время последействия.
Время латентного периода ЛС, особенно при ургентных ситуациях, определяет их выбор. Так, в одних случаях латентный период составляет секунды (сублингвальная форма нитроглицерина), в других - дни и недели (аминохинолин). Длительность латентного периода может быть обусловлена постоянным накоплением ЛС (аминохинолин) в месте его воздействия. Нередко длительность латентного периода зависит от опосредованного механизма действия (гипотензивный эффект β-адреноблокаторов).
Время удержания эффекта - объективный фактор, определяющий кратность назначения и длительность применения ЛС.
Подразделяя ЛС по фармакологическим эффектам, необходимо учитывать, что в основе одного и того же симптома лежат различные механизмы действия. Примером служит гипотензивное влияние таких ЛС, как диуретики, β-адреноблокаторы, блокаторы медленных кальциевых каналов (различные механизмы действия производят один и тот же клинический эффект). Этот факт учитывают при выборе ЛС или их комбинации при проведении индивидуальной фармакотерапии.
Существуют факторы, влияющие на скорость наступления эффекта, его силу и продолжительность при применении лекарственных веществ.
Скорость, способ введения и доза ЛС, взаимодействующего с рецептором. Например, внутривенное струйное введение 40 мг фуросемида производит более быстрый и выраженный диуретический эффект, чем 20 мг препарата, введённого внутривенно или 40 мг диуретика, принятого внутрь.
Тяжёлое течение заболевания и связанные с ним органические поражения органов и систем. Большое влияние на функциональное состояние основных систем оказывают и возрастные аспекты.
Взаимодействие используемых ЛС (см. главу 5 «Взаимодействие лекарственных средств»).
Важно знать, что применение некоторых ЛС оправдано лишь при условии первоначального патологического изменения системы или акцепторов мишени. Так, жаропонижающие ЛС (антипиретики) снижают температуру только при лихорадке.
Лиганды внутриклеточных рецепторов гидрофобны и свободно проникают через клеточные мембраны. Действие связано с регуляцией экспрессии генов. 2 типа рецепторов: I типа: Рецепторы в ядре; II типа: Рецепторы в цитозоле, комплекс L-R стабилизируется белками теплового шока (HSP). При активации - Рецептор димеризуется.
1) гормон проходит через двойной липидный слой клеточной мембраны; 2) H+R приводит к изменению конформации R и снижению сродства к белкам-шаперонам, отделяющимся от комплекса H+R. 3) H+R проходит в ядро, взаимодействует с регуляторной нуклеотидной последовательностью в ДНК (гормон-зависимыми элементами (hormone response elements, HREs)) - энхансером или сайленсером. 4) увеличивается (при взаимодействии с энхансером) или уменьшается (при взаимодействии с сайленсером) доступность промотора для РНК-полимеразы. 5) соответственно увеличивается или уменьшается скорость транскрипции структурных генов, скорость трансляции, изменяется количество белков.
4 группы рецепторов : стероидных, тиреоидных, ретиноевых и орфановых рецепторов, которые подразделяются на 10 подгрупп.
 Стероидные:
глюкокортикоидные (с помощью домена P-box узнают GRE) и эстрогеновые (имеют тот же HRE с тиреоидными, так что тиреоидные гормоны могут вз-ть с ERE). Эстрогеновые, и тиреоидные Рецепторы могут взаимодействовать с ДНК лиганд-независимым образом, т.е. без связанного гормона.
Стероидные:
глюкокортикоидные (с помощью домена P-box узнают GRE) и эстрогеновые (имеют тот же HRE с тиреоидными, так что тиреоидные гормоны могут вз-ть с ERE). Эстрогеновые, и тиреоидные Рецепторы могут взаимодействовать с ДНК лиганд-независимым образом, т.е. без связанного гормона.
1 - аминокислотные остатки, участвующие в связывании ДНК; 2 - область димеризации. Центральный ДНК-связывающий домен содержит 2 "цинковых пальца". Атомы цинка связаны с аминокислотной последовательностью через остатки цистеина. Функциональные области 1 и 2 отвечают соответственно за связывание ДНК и димеризацию рецептора .
 Тиреоидные гормоны
: имеют короткий участок называемый A/B, и P-box. Могут связывать НRE без лиганда. Не формируют стаб. комплексов с HSP, но могут кратковременно связываться с ними в процессе синтеза.
Тиреоидные гормоны
: имеют короткий участок называемый A/B, и P-box. Могут связывать НRE без лиганда. Не формируют стаб. комплексов с HSP, но могут кратковременно связываться с ними в процессе синтеза.
Общая структура: 1) N-концевой участок, модилирующая функция, в отсутствии лиганда связан с HSP 2) ДНК-связывающий домен, содержит мотив "zinc finger" , в каждом "цинковом пальце" атом цинка связан с 4 остатками цистеина 3) С-концевой, связывает лиганд.
4 домена, разделенных шарнирным участком, части обозначаются А-D начиная с N-конца. Домены С и Е наиболее консервативны, но различия в домене Е обеспечивают связывание разных лигандов. Домены А/В наиболее вариабельны и изоформы отличаются главным образом по домену А, что обеспечивает их различия в отношении активации транскрипции.
N-концевой A/B – функции: активация транскрипции, субдомен TAD1, обеспечивает синергизм и генную избирательность транскрипционной активности. Синнергизм- активация нескольких HRE оказывает существенно больший эффект на транскрипцию, чем арифметическая сумма эффектов индивидуальных HRE. Селективность- что группа транскрипционных факторов, связанных с локусом TAD1, может активировать другой набор генов, чем факторы, связывающиеся с последовательностью TAD2 (расположена в домене Е).
ДНК-связывающий С-домен (DBD) состоит из двух “цинковых пальцев”, стабилизированных α-спиралями, а также дополнительных линейных структур (T-box и A-box). Каждый Zn 2+ -связывающий участок содержит две пары цистеинов. В третичной структуре спирали располагаются перпендикулярно друг другу так, что N-концевая спираль ориентируется поперек ДНК и попадает в канавку между ее витками, а С-концевая лежит сверху вдоль нити ДНК. P-box находится в N-конце первой спирали; он непосредственно узнает и связывает HRE.
Некоторые представители тиреоидных рецепторов имеют 2 дополнительные последовательности к С-концу от второй спирали: T-box нужен для димеризации рецептора, и A-box (или H-box) взаимодействует с A/T-богатой последовательностью к 5’-концу от HRE.
Шарнирный участок D разделяет DBD и лиганд-связывающий домен (LBD), обеспечивая им относительную подвижность. Главной функцией D-участка является ядерная локализация рецептора. Он несет специальную последовательность импорта белка в ядро (n uclear l ocalization s ignal, NLS), которая узнается транспортными системами ядра. Участвует в димеризации и связывании ДНК, поскольку фактически в нем расположены A-box и T-box. Некоторые остатки, участвующие в узнавании лиганда и входящие в протяженные лиганд-связывающие последовательности LBD, также попадают в участок D. Здесь связываются некоторые коактиваторы и репрессоры транскрипции. Наиболее важными из них являются белки HMGB (high mobility group B), которые повышают сродство стероидных рецепторов к ДНК.
Лиганд-связывающий домен Е (LBD) Функции: связывание лиганда; активация транскрипции, димеризация рецептора и связывание белков теплового шока. Пространственная структура LBD имеет тип сэндвича, построенного тремя взаимоперпендикулярными уровнями α-спиралей.
F-домен является просто С-концевым. У многих ядерных рецепторов вся эта последовательность участвует в связывании гормона и формально относится к LBD; эти Рецепторы фактически лишены F-домена. В тех же рецепторах, где этот домен присутствует, с ним связан весьма ограниченный набор второстепенных функций. Однако для эстрогеновых рецепторов этот домен важен, так как он участвует в связывании коактиваторов.
Рецепторная функция - это важнейшая способность клетки адекватно реагировать на сигналы внешней и внутренней среды, позволяющая приспосабливаться к меняющимся условиям существования.
Сигналы - это различные вещества или виды энергии, передающие в клетку определенную информацию. Сигналы могут быть:
Химическими - гормоны, медиаторы, факторы роста, цитокины и др.; пахучие вещества или отличающиеся вкусом;
Физическими - свет, звук, температура, давление, электрические потенциалы;
Физико-химическими - осмотическое давление, напряжение О 2 или СО 2 ;
Сложными.
Клеточные рецепторы - это генетически детерминированные макромолекулы, локализованные в различных областях клетки и специализированные на восприятии биологически значимых специфических сигналов химической и физической природы. По своей структуре рецептор состоит из 3 доменов:
1) внемембранного - обеспечивает связывание с сигнальным веществом - лигандом;
2) трансмембранного - переносит сигнал, способен к трансформации;
3) цитоплазматического - обеспечивает внутриклеточные процессы - реакцию на сигнал.
Клеточные рецепторы делят на 2 группы:
Рецепторы плазматической мембраны;
Внутриклеточные рецепторы – цитоплазматические и ядерные.
Рецепторы плазматической мембраны расположены на поверхности плазмолеммы и способны высокоспецифически связываться с лигандами. По химической природе это преимущественно гликопротеины.
Рецепторы выполняют функции:
1) регулируют проницаемость плазмолеммы, изменяя конформацию белков и ионных каналов;
2) регулируют поступление некоторых молекул в клетку;
3) действуют как датчики, превращая внеклеточные сигналы во внутриклеточные;
4) связывают молекулы внеклеточного матрикса с цитоскелетом; эти рецепторы называются интегринами , они обеспечивают формирование контактов между клетками и клеткой и межклеточным веществом.
Рецепторы плазматической мембраны можно разделить на 5 семейств:
- рецепторы, связанные с каналами , взаимодействуют с лигандом - нейромедиатором, который временно открывает или закрывает воротный механизм, в результате чего начинается или блокируется транспорт ионов через канал. Каналообразующие рецепторы состоят из ассоциированных белковых субъединиц, специфически пропускающих ионы. С этими рецепторами взаимодействуют глютаминовая кислота, γ-аминомасляная кислота, глицин, циклические мононуклеотиды (цАМФ, цГМФ);
- каталитические рецепторы включают внеклеточную часть (собственно рецептор, который воспринимает сигнал) и цитоплазматическую часть, которая работает как протеинкиназа. Информация сигнальной молекулы приводит к началу каскада биохимических изменений в клетке, что приводит к определенному физиологическому ответу. На такие рецепторы воздействует инсулин, эпидермальный и тромбоцитарный фактор роста, фактор роста нервов.
- рецепторы, связанные с G-белками - это трансмембранные белки, связанные с ионным каналом или ферментом. Это целый комплекс молекул, который включает:
1) сам рецептор, взаимодействующий с сигнальной молекулой (первый посредник) - это интегральный белок, который 7 раз прошивает плазмолемму, внутриклеточные петли этих рецепторов содержат центры связывания G-белка (например, β-адренорецептор);
2) G-белок (гуанозин трифосфат-связывающего регуляторный белок, состоящий из нескольких компонентов), который передает сигнал на связанный с мембраной фермент (аденилатциклазу) или ионный канал, после чего активируется;
3) второй внутриклеточный посредник - чаще циклический АМФ или ГМФ (цАМФ, гАМФ) или Са 2+ .
Через такие рецепторы реализуются эффекты 80 % нейромедиаторов, пептидных гормонов;
- иммуноглобулиновые рецепторы - это рецепторы-иммуноглобулины на поверхности макрофагов и иммунокомпетентных клеток, обеспечивающие распознавание всего чужеродного и иммунный ответ организма.
- интегрины - клеточные адгезионные молекулы - трансмембранные белки, которые служат рецепторами для внеклеточных фибриллярных макромолекул - фибронектина и ламинина. Фибронектин связывается с клетками и молекулами внеклеточного матрикса (коллагеном, гепарином, фибрином). Фибронектин как адгезионный мостик между клеткой и межклеточным веществом. Внутриклеточная часть интегрина соединяется через другие белки (винкулин, талин, α-актинин) с цитоскелетом.
Таким образом, рецепторы плазмолеммы воспринимают различные сигналы, которые при необходимости изменяют метаболизм в клетке, инициируют и регулируют сокращения, секрецию клетки, модулируют электрический потенциал на поверхности мембраны.
Внутриклеточные рецепторы. Внутриклеточные рецепторы являются белками, регулирующими генную активность клетки. Они располагаются:
В цитоплазме и в мембране органелл. Цитоплазматические рецепторы обнаружены для стероидных гормонов, например, для глюко- и минералокортикоидов, андрогенов и прогестерона. Митохондрии имеют рецепторы к тиреоидным гормонам;
В ядре - ядерные рецепторы для тиреоидных гормонов, рецепторов для эстрогенов, витамина Д, ретиноевой кислоты.
Рецепторы для стероидных гормонов имеют 3 домена (части):
1) гормон-связывающий - для взаимодействия с лигандом;
2) ДНК-связывающий;
3) домен, активирующий транскрипцию.
Сигнальные молекулы для таких рецепторов гидрофобные и свободно диффундируют через плазмолемму, затем связываются с внутриклеточными белками-рецепторами. После этого изменяется конформация белка, происходит его активация, повышается сродство к ДНК. Такие гормон-рецепторные комплексы связываются со специфическими генами в ядре, и, регулируя их экспрессию, обеспечивают биосинтез ряда ферментов, изменяющих функциональное состояние клетки.
ТЕМА 5
МЕЖКЛЕТОЧНЫЕ СОЕДИНЕНИЯ, ТИПЫ И СТРУКТУРНО-
ФУНКЦИОНАЛЬНАЯ КЛАССИФИКАЦИЯ
Межклеточные соединения - это специальные структуры, которые вместе с плазмолеммой обеспечивают взаимодействие между клетками. Межклеточные контакты обеспечиваются гликокаликсом и связанными с ним белками. Межклеточные соединения можно подразделить на 2 основных вида:
1. Механические соединения - обеспечивают механическую связь клеток друг с другом. К ним относят простые и сложные соединения: плотные соединения (плотный контакт), десмосомы, интердигитации.
2. Коммуникационные соединения - обеспечивают химическую связь между клетками. К ним относят щелевые соединения.
Механические соединения
I. Простое межклеточное соединение - сближение плазмолемм соседних клеток на расстояние 15–20 нм. При этом гликопротеиды соседних клеток специфичны и «узнают» друг друга, то есть являются рецепторами (кадгерины, интегрины). Обязательным условием соединения является наличие ионов Са 2+ . Например, Е-кадгерины обеспечивают соединение эпителиальных клеток по всей контактирующей поверхности (рисунок 3).
Рисунок 3 - Простое межклеточное соединение (схема):