Йо-йо тест. Основная проблема. Определение чувствительности к амп Интерпретация результатов определения чувствительности
Классификация, общие подходы к проведению. Диффузионные методы: метод бумажных дисков, Е-тест.Методы определения чувствительности бактерий к антибиотикам делятся на 2 группы:
1. Диффузионные методы:
. с использованием дисков с антибиотиками
. с помощью Е-тестов
2. Методы серийных разведений:
. разведение в жидкой питательной среде (бульоне)
. разведение в агаризованной среде
Методы определения чувствительности были разработаны во второй половине 60-х - начале 70-х годов XX века и с тех пор с методической точки зрения не претерпели принципиальных изменений.
Для всех методов общими являются следующие этапы:
- приготовление и проверка качества питательных сред
- приготовление суспензии исследуемых микроорганизмов (инокулюма)
- инокуляция
- для дифузионных методов - этап наложения дисков или полосок Е-теста на плотную питательную среду.
- инкубирование
- учет и интерпретация результатов
- формулировка рекомендаций по Лечению
Диффузионные методы основаны на диффузии антибактериального препарата (АБП) из носителя в плотную питательную среду, инокулированную микроорганизмом, и регистрации диаметра зоны ингибирования (задержки) роста исследуемого микроорганизма.
. Метод менее чувствителен и менее точен, чем метод серийных разведений, но на практике применяется чаще из-за своей простоты. Размещено на реф.рф.
. Скорость диффузии в агар любого препарата зависит от его структуры, молекулярной массы, наличия примесей, состава и рН среды.
Метод бумажных дисков с антибиотиком (дискодиффузионный метод).
. Для проведения этого метода используют стандартные диски, содержащие определенное количество антибиотиков, и стандартную питательную среду, необходимую для роста данного вида микроорганизма. В определенных пределах величина диаметра зоны подавления роста обратно пропорциональна МПК. . На поверхность агара в чашке Петри наносят бактериальную суспензию определенной плотности. . Помещают диски, содержащие определенное количество антибиотика. . Инкубируют при уcловиях, благоприятных для каждого конкретного микроорганизма. . Измеряют диаметры зон задержки роста вокруг диска в миллиметрах (с учетом диаметра диска). . Оценивают результат по специальной таблице путем сопоставления диаметра зон задержки роста испытанной культуры с пограничными значениями диаметра зоны в таблице. . Исследуемую культуру относят к одной из трех категорий: чувствительная, умеренно- чувствительная и устойчивая 
Е-тест (E-test или эпсилометрический метод)
Метод близок по технологии постановки к методу бумажных дисков.
. В качестве носителя используется узкая полоска полимера (0.5х6.0 см), на которую нанесен градиент концентраций АБП (от минимальных до максимальных). Значения концентрации АБП в каждом участке полоски нанесены на наружной (обращенной к исследователю) поверхности.
. Ингибирование роста микроорганизма вокруг полоски носителя происходит в зоне, где концентрация антибиотика, диффундирующего из носителя, выше МПК.
. В месте пересечения эллипсовидной зоны подавления роста с полоской Е- теста получают значение МПК.
Е-тест сочетает простоту постановки метода бумажных дисков и точность метода серийных разведений
Методы, используемые для сравнительной оценки in vitro лекарственных средств антимикробной терапии: метод серийных разведений в жидкой и плотной питательных средах.
Методы серийных разведений:
. Позволяют количественно оценить чувствительность выделенного микроорганизма к антибактериальным средствам и определить МПК препарата.
. Используют для сравнительной оценки антимикробной активности in vitro разрабатываемого препарата-генерика и оригинального средства.
. Для определения величины МПК заданные концентрации антибиотиков вносят в питательную среду, которую затем засевают культурой исследуемого микроорганизма. После инкубации оценивают наличие или отсутствие видимого роста.
. Основаны на использовании двукратных последовательных разведений концентраций АБП от максимальной к минимальной (например, от 128 мкг/мл, 64 мкг/мл, и т.д. до 0,5 мкг/мл, 0,25 мкг/мл и 0,125 мкг/мл).
. Проводятся в жидкой и агаризованной питательных средах. Метод серийных разведений в жидкой питательной среде (бульоне)
Существует 2 варианта данного метода:
макрометод (пробирочный) и микрометод (планшетный).
Макрометод.
. Тестирование проводят в пробирках в конечном объеме 1 мл для каждого разведения.
. Питательный бульон разливают по 0,5 мл в каждую пробирку. Количество пробирок определяют необходимым диапазоном разведений АБП.
. Приготовление суспензии исследуемых микроорганизмов:
- Из стандартной суспензии каждого исследуемого микроорганизма (~ 10 8 КОЕ/мл) готовят рабочую суспензию (~ 10 6 КОЕ/мл) . Приготовление двукратных серийных разведений АБП: - готовят основной раствор АБП исследуемого препарата-генерика и препарата сравнения (оригинального) в концентрации 1000 мкг/мл и выше (с учетом содержания содержания активного вещества). -из основных растворов АБП исследуемого препарата-генерика и препарата сравнения (оригинального) готовят рабочие растворы АБП с использованием жидкой питательной среды. (Концентрация рабочих растворов рассчитывается исходя из необходимой максимальной концентрации в ряду серийных разведений с учетом фактора разбавления при последующей инокуляции суспензией микроорганизма) ‐ готовят серийные разведения: 0,5 мл рабочего раствора АБП вносят в первую пробирку, содержащую 0,5 мл бульона. Перемешивают. Новой пипеткой (наконечником) переносят 0,5 мл раствора АБП в бульоне во вторую пробирку, содержащую 0,5 мл бульона и т.д., пока не будет приготовлен весь необходимый ряд разведений. Из последней пробирки 0,5 мл удаляют. Т.о., получают ряд пробирок с растворами АБП, концентрации в которых отличаются в соседних пробирках в 2 раза. Инокуляция: по 0,5 мл микробной суспензии с концентрацией микроорганизма ~ 10 6 вносят в каждую пробирку с 0,5 мл соответствующего разведения АБП. Конечная концентрация микроорганизма в каждой пробирке ~ 5х10 5 КОЕ/мл. . Контроль - пробирка с бульоном и культурой микроорганизма (контроль роста). Отрицательный контроль - пробирка с бульоном (контроль стерильности). . Инкубирование: все пробирки, закрытые пробками, или колпачками, инкубируют при условиях, обеспечивающих рост испытуемых микроорганизмов. . Учет и интерпретация результатов: пробирки с посевами просматривают в проходящем свете. Рост культуры в пробирке с АБП сравнивают с контрольной пробиркой. - наличие роста микроорганизма в бульоне (помутнение бульона) свидетельствует о том, что данная концентрация антибиотика недостаточна, чтобы подавить его жизнеспособность. ‐ по мере увеличения концентрации антибиотика рост микроорганизма ухудшается. Первую наименьшую концентрацию антибиотика (из серии последовательных разведений), где визуально не определяется бактериальный рост принято считать минимальной подавляющей концентрацией (МПК). лекарственных средств антибактериальной терапии - сравнивают результаты, полученные для оригинального ЛС и исследуемого генерического ЛС. Делают вывод об их эквивалентности в отношении спектра (перечень используемых микрорганизмов) и степени антимикробной активности (значения МПК). . Определение МБК: из нескольких последних пробирок с задержкой роста делают посев петлей на сектора чашки Петри. За МБК, которая, как правило, на несколько разведений меньше МПК, принимают концентрацию препарата в последней пробирке, посев из которой не дал роста. . Недостаток метода: низкая производительность - применение ограничивается исследованиями небольшого числа микроорганизмов.
. Определение МБК: из нескольких последних пробирок с задержкой роста делают посев петлей на сектора чашки Петри. За МБК, которая, как правило, на несколько разведений меньше МПК, принимают концентрацию препарата в последней пробирке, посев из которой не дал роста. . Недостаток метода: низкая производительность - применение ограничивается исследованиями небольшого числа микроорганизмов.
Микрометод
.Процедура проведения испытания аналогична таковой при использовании макрометода
.Величина конечного объема - до 0,2 мл.Наличие соответствующего оснащения лаборатории: планшет на 96 лунок со стерильными крышками, многоканальных пипеток.Рабочие растворы АБП можно вносить в лунки планшет заранее, после чего хранить запаянными в полиэтилене при температуре ниже 60°С до момента использования. . Преимущества метода: - высокая производительность - возможность длительного хранения заранее приготовленных планшет - экономия расходных материалов. Размещено на реф.рф
Метод серийных разведений в агаризованной среде. Принцип проведения испытания аналогичен методу разведений в бульоне. Приготовление суспензии исследуемых микроорганизмов: - стандартная суспензия каждого исследуемого микроорганизма должна содержать ~ 10 8 КОЕ/мл. - стандартную микробную суспензию для проведения эксперимента разводят ~ в 10 раз до получения концентрации микроорганизма ~ 10 7 КОЕ/мл. Приготовление двукратных серийных разведений АБП для оригинального препарата и исследуемого препарата- генерика проводят аналогично методу разведений в бульоне. Агаризованную среду расплавляют и охлаждают до температуры 45-50°С. . Приготовление чашек с агаризованной средой и разведениями АБП: смешивают агаризованную среду и растворы АБП непосредственно в чашке Петри (для пластиковых чашек диаметром 90 мм к 2 мл раствора АБП добавляют 18 мл расплавленного и охлажденного агара). . Инокуляция и инкубирование: бактериологической петлей переносят 1-2 мкл суспензии исследуемых микроорганизмов на поверхность агаризованной среды. Таким образом, конечная посевная доза составляет ~ 10 4 КОЕ (стандартная бактериологическая петля диаметром 3 мм переносит 1-2 мкл жидкости). . На поверхности агара образуется пятно диаметром 5-8 мм. После подсыхания чашки переворачивают и инкубируют при условиях, благоприятных для роста исследуемых микроорганизмов. . Учет и интерпретация результатов: аналогично методу разведения в бульоне. Чашки Петри помещают на темную, не отражающую свет поверхность. За МПК принимают концентрацию АБП, вызвавшую полное ингибирование видимого роста. . Контроль: инокулированные суспензией культур микроорганизмов чашки с агаром без АБП (контроль роста). Отрицательный контроль: чашки с агаром (контроль стерильности). Преимущества метода: на одной чашке можно определять чувствительность нескольких микроорганизмов.
Объем исследований по сравнительной оценке in vitro антимикробной активности для генерических и оригинальных средств антимикробной терапии.
Объем исследований по сравнительной оценке in vitro антимикробной активности генерических противомикробных лекарственных средств:
.Задача исследования: подтверждение соответствия генерического препарата референсному (оригинальному) по спектру (микроорганизмы) и степени (значение МПК, МБК) антимикробной активности.
.Набор тестируемых микроорганизмов: по 1-2 штамма каждого из входящих в спектр действия микроорганизмов
- эталонные коллекционные штаммы
-выделенные в стационарах клинические штаммы
.Определяются значения МПК и МБК
.Контроль: препарат сравнения - оригинальный препарат
.Ожидаемый результат: МПК и МБК разрабатываемых генерических противомикробных ЛС входят в допустимые диапазоны значений и полностью совпадают с МПК и МБК препаратов сравнения (оригинальных ЛС) в отношении коллекционных и клинических штаммов.
Порядок исследований по определению in vitro антимикробной активности новых противомикробных соединений:
.Первичная оценка чувствительности к новым соединениям эталонных штаммов различных видов грамотрицательных и грамположительных микроорганизмов (4-5 штаммов для каждого вида);
.Детальное изучение степени антибактериальной активности соединений в отношении штаммов грамотрицательных и грамположительных микроорганизмов из международных коллекций с известными механизмами резистентности (метод серийных разведений);
.Исследование активности в отношении клинических штаммов условно патогенных и патогенных микроорганизмов в сравнении с известными препаратами близкой химической группы или аналогичными по антимикробному эффекту:
- в случае преимущественной активности в отношении грамположительных микроорганизмов контроль - природные пенициллины, цефалоспорины I - II поколений, макролиды, линкозамиды; - при активности в отношении грамотрицательных микроорганизмов контроль - полимиксин В, азтреонам; -для препаратов широкого спектра действия контроль - полусинтетические пенициллины, аминогликозиды, тетрациклины, цефалоспорины III - IV поколений
. Оценка антимикробной активности в отношении проблемных возбудителей: метициллинорезистентные стафилококки, устойчивые к бензилпенициллину Streptococcus pneumonia, множественноустойчивые энтеробактерии, устойчивые к аминогликозидам бактерии рода Pseudomonas и др.
.Первоначальные терапевтические концентрации новых препаратов устанавливаются с учетом токсичности, определенной в опытах по изучению острой токсичности;
. Сравнительную степень антибактериальной активности препаратов оценивают величиной МПК или МБК, определяемых не менее, чем при 2-х значениях посевной дозы: минимальной - 10 4 - 10 5 КОЕ/мл и максимальной - 10 6 - 10 9 КОЕ/мл в зависимости от вида возбудителя; На сегодняшний день не существует методов, которые позволили бы с абсолютной достоверностью прогнозировать клинический эффект антибиотиков при лечении инфекционных болезней. Однако, данные результатов определения чувствительности могут служить хорошим ориентиром клиницистам для выбора и коррекции антибактериальной терапии.
Оглавление книги открыть закрыть
1. Фармацевтическая микробиология. Предмет и задачи фармацевтической микробиологии.
2. Фармация и фармацевтика: история возникновения и развития.
3. Лекарственное средство: определение, классификация.
4. Состав лекарственных средств | фармацевтическая субстанция, вспомогательное вещество.
5. Оригинальные и генерические лекарственные средства. Наименование лекарственных средств.
10. Действие повреждающих факторов на микроорганизмы. Влияние температурного фактора и его использование в фармацевтике.
11. Действие излучения на микроорганизмы, типы излучения.
12. Влияние на микроорганизмы химических повреждающих факторов
13. Стерилизация. Уровень гарантии стерильности (SAL). Критерии выбора метода стерилизации.
14. Термическая и химическая стерилизация
15. Контроль эффективности работы стерилизующих устройств.
16. Промышленная дезинфекция
17. Дезинфектанты и антисептики. Требования, предъявляемые к химическим дезинфектантам и антисептикам.
18. Консерванты и их использование в фармацевтическом производстве
В лекции рассмотрены основные методы определения чувствительности in vitro микроорганизмов к антимикробным препаратам (диско-диффузионный, Е-тестов, методы разведения). Отражены подходы к эмпирическому и этиотропному назначению антибиотиков в клинической практике. Обсуждены вопросы интерпретации результатов определения чувствительности с клинической и микробиологической точек зрения.
В настоящее время в клинической практике существуют два принципа назначения антибактериальных препаратов: эмпирическое и этиотропное. Эмпирическое назначение антибиотиков основано на знаниях о природной чувствительности бактерий, эпидемиологических данных о резистентности микроорганизмов в регионе или стационаре, а также результатах контролируемых клинических исследований. Несомненным преимуществом эмпирического назначения химиопрепаратов является возможность быстрого начала терапии. Кроме того, при таком подходе исключаются затраты на проведение дополнительных исследований.
Однако при неэффективности проводимой антибактериальной терапии, при нозокомиальных инфекциях, когда затруднительно предположить возбудителя и его чувствительность к антибиотикам стремятся проводить этиотропную терапию. Этиотропное назначение антибиотиков предполагает не только выделение возбудителя инфекции из клинического материала, но и определение его чувствительности к антибиотикам. Получение корректных данных возможно только при грамотном выполнении всех звеньев бактериологического исследования: от взятия клинического материала, транспортировки его в бактериологическую лабораторию, идентификации возбудителя до определения его чувствительности к антибиотикам и интерпретации полученных результатов.
Вторая причина, обусловливающая необходимость определения чувствительности микроорганизмов к антибактериальным препаратам - это получение эпидемиологических данных о структуре резистентности возбудителей внебольничных и нозокомиальных инфекций. В практике эти данные используют при эмпирическом назначении антибиотиков, а также для формирования больничных формуляров.
Методы определения чувствительности к антибиотикам
Методы определения чувствительности бактерий к антибиотикам делятся на 2 группы: диффузионные и методы разведения.
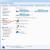
При определении чувствительности диско-диффузионным методом на поверхность агара в чашке Петри наносят бактериальную суспензию определенной плотности (обычно эквивалентную стандарту мутности 0,5 по McFarland) и затем помещают диски, содержащие определенное количество антибиотика. Диффузия антибиотика в агар приводит к формированию зоны подавления роста микроорганизмов вокруг дисков. После инкубации чашек в термостате при температуре 35 о -37 о С в течение ночи учитывают результат путем измерения диаметра зоны вокруг диска в миллиметрах ().
Рисунок 1. Определение чувствительности микроорганизмов диско-диффузионным методом.
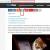
Определение чувствительности микроорганизма с помощью Е-теста проводится аналогично тестированию диско-диффузионным методом. Отличие состоит в том, что вместо диска с антибиотиком используют полоску Е-теста, содержащую градиент концентраций антибиотика от максимальной к минимальной (). В месте пересечения эллипсовидной зоны подавления роста с полоской Е-теста получают значение минимальной подавляющей концентрации (МПК).

Рисунок 2. Определение чувствительности микроорганизмов с помощью Е-тестов.
Несомненным достоинством диффузионных методов является простота тестирования и доступность выполнения в любой бактериологической лаборатории. Однако с учетом высокой стоимости Е-тестов для рутинной работы обычно используют диско-диффузионный метод.
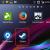
Методы разведения основаны на использовании двойных последовательных разведений концентраций антибиотика от максимальной к минимальной (например от 128 мкг/мл, 64 мкг/мл, и т.д. до 0,5 мкг/мл, 0,25 мкг/мл и 0,125 мкг/мл). При этом антибиотик в различных концентрациях вносят в жидкую питательную среду (бульон) или в агар. Затем бактериальную суспензию определенной плотности, соответствующую стандарту мутности 0,5 по MсFarland, помещают в бульон с антибиотиком или на поверхность агара в чашке. После инкубации в течение ночи при температуре 35 о -37 о С проводят учет полученных результатов. Наличие роста микроорганизма в бульоне (помутнение бульона) или на поверхности агара свидетельствует о том, что данная концентрация антибиотика недостаточна, чтобы подавить его жизнеспособность. По мере увеличения концентрации антибиотика рост микроорганизма ухудшается. Первую наименьшую концентрацию антибиотика (из серии последовательных разведений), где визуально не определяется бактериальный рост принято считать минимальной подавляющей концентрацией (МПК) . Измеряется МПК в мг/л или мкг/мл ().

Рисунок 3. Определение значения МПК методом разведения в жидкой питательной среде.
Интерпретация результатов определения чувствительности
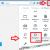
На основании получаемых количественных данных (диаметра зоны подавления роста антибиотика или значения МПК) микроорганизмы подразделяют на чувствительные, умеренно резистентные и резистентные (). Для разграничения этих трех категорий чувствительности (или резистентности) между собой используют так называемые пограничные концентрации (breakpoint) антибиотика (или пограничные значения диаметра зоны подавления роста микроорганизма).

Рисунок 4. Интерпретация результатов определения чувствительности бактерий в соответствии со значениями МПК.
Пограничные концентрации не являются неизменными величинами. Они могут пересматриваться, в зависимости от изменения чувствительности популяции микроорганизмов. Разработкой и пересмотром критериев интерпретации занимаются ведущие специалисты (химиотерапевты и микробиологи), входящие в специальные комитеты. Одним из них является Национальный комитет по клиническим лабораторным стандартам США (National Committee for Clinical Laboratory Standards - NCCLS). В настоящее время стандарты NCCLS признаны в мире и используются как международные для оценки результатов определения чувствительности бактерий при многоцентровых микробиологических и клинических исследованиях.
Существуют два подхода к интерпретации результатов определения чувствительности: микробиологический и клинический. Микробиологическая интерпретация основана на анализе распределения значений концентраций антибиотика, подавляющих жизнеспособность бактерий. Клиническая интерпретация основана на оценке эффективности антибактериальной терапии.
Чувствительные микроорганизмы (susceptible)
Клинически к чувствительным относят бактерии (с учетом параметров, полученных in vitro ), если при лечении стандартными дозами антибиотика инфекций, вызываемых этими микроорганизмами, наблюдают хороший терапевтический эффект.
При отсутствии достоверной клинической информации подразделение на категории чувствительности базируется на совместном учете данных, полученных in vitro , и фармакокинетики, т.е. на концентрациях антибиотика, достижимых в месте инфекции (или в сыворотке крови).
Резистентные микроорганизмы (resistant)
К резистентным (устойчивым) относят бактерии, когда при лечении инфекции, вызванной этими микроорганизмами, нет эффекта от терапии даже при использовании максимальных доз антибиотика. Такие микроорганизмы имеют механизмы резистентности.
Микроорганизмы c промежуточной резистентностью (intermediate)
Клинически промежуточную резистентность у бактерий подразумевают в случае, если инфекция, вызванные такими штаммами, может иметь различный терапевтический исход. Однако лечение может быть успешным, если антибиотик используется в дозировке, превышающей стандартную, или инфекция локализуется в месте, где антибактериальный препарат накапливается в высоких концентрациях.
С микробиологической точки зрения к бактериям с промежуточной резистентностью относят субпопуляцию, находящуюся в соответствии со значениями МПК или диаметра зон, между чувствительными и резистентными микроорганизмами. Иногда штаммы с промежуточной резистентностью и резистентные бактерии объединяют в одну категорию резистентных микроорганизмов.
Необходимо отметить, что клиническая интерпретация чувствительности бактерий к антибиотикам является условной, поскольку исход терапии не всегда зависит только от активности антибактериального препарата против возбудителя. Клиницистам известны случаи, когда при резистентности микроорганизмов, по данным исследования in vitro , получали хороший клинический эффект. И наоборот, при чувствительности возбудителя может наблюдаться неэффективность терапии.
В определенных клинических ситуациях, когда недостаточно результатов исследования чувствительности обычными методами, определяют минимальную бактерицидную концентрацию.
Минимальная бактерицидная концентрация (МБК) - наименьшая концентрация антибиотика (мг/л или мкг/мл), которая при исследовании in vitro вызывает гибель 99,9% микроорганизмов от исходного уровня в течение определенного периода времени.
Значение МБК используют при терапии антибиотиками, обладающими бактериостатическим действием, или при отсутствии эффекта от антибактериальной терапии у особой категории больных. Частными случаями для определения МБК могут быть, например, бактериальный эндокардит, остеомиелит или генерализованные инфекции у пациентов с иммунодефицитными состояниями.
В заключение хотелось бы отметить, что на сегодняшний день не существует методов, которые позволили бы с абсолютной достоверностью прогнозировать клинический эффект антибиотиков при лечении инфекционных болезней. Однако, данные результатов определения чувствительности могут служить хорошим ориентиром клиницистам для выбора и коррекции антибактериальной терапии.
Таблица 1. Критерии интерпретации чувствительности бактерий
В этой части мы рассмотрим сквозное (E2E) тестирование: протестируем всё приложение целиком, причём сделаем это с точки зрения пользователя, по сути, автоматизируя все его действия.
В нашем случае приложение состоит только из фронтенда - бэкенда попросту нет, поэтому E2E-тестирование будет заключаться в открытии приложения в реальном браузере, выполнении набора вычислений и проверке валидности значения на экране.
Нужно ли проверять все перестановки, как мы делали это в юнит-тестах? Нет, ведь это уже проверено! В E2E-тестах мы проверяем работоспособность не отдельных юнитов, а всей системы сразу.
Сколько нужно E2E-тестов?
Первая причина, по которой таких тестов не должно быть много, - хорошо написанных интеграционных и юнит-тестов должно хватить. E2E-тесты должны проверить, что все элементы корректно связаны между собой.
Вторая причина - они медленные. Если их будет сотня, как юнит-тестов и интеграционных, то тестирование будет проходить очень долго.
Третья причина - непредсказуемое поведение E2E-тестов. О таком явлении есть пост в блоге Google, посвященном тестированию. В юнит-тестах не наблюдается такого нестабильного поведения. Они могут то проходить, то падать - причем без видимых изменений, исключительно из-за I/O. Можно ли убрать непредсказуемость? Нет, но можно свести её к минимуму.
Чтобы избавиться от непредсказуемости, делайте как можно меньше E2E-тестов. Пишите один E2E-тест на десять других, и лишь тогда, когда они действительно необходимы.
Пишем E2E-тесты
Перейдём к написанию E2E-тестов. Нам нужны две вещи: браузер и сервер для нашего фронтенд-кода.
Сперва взглянем на настройку веб-сервера.
Настройка веб-сервера в Mocha
Веб-сервер на Node? На ум сразу же приходит express , давайте посмотрим код:
Let server before((done) => { const app = express() app.use("/", express.static(path.resolve(__dirname, "../../dist"))) server = app.listen(8080, done) }) after(() => { server.close() })
В функции before мы создаем express-приложение, указываем ему папку dist и прописываем слушать порт 8080. В функции after мы «убиваем» сервер.
Папка dist - это то место, где мы храним наши JS-скрипты и куда копируем HTML- и CSS-файлы. Вы можете увидеть, что мы делаем это в сборочном скрипте npm в package.json:
{ "name": "frontend-testing", "scripts": { "build": "webpack && cp public/* dist", "test": "mocha "test/**/test-*.js" && eslint test lib", ... },
Это значит, что для E2E-тестов нужно сначала выполнить npm run build , а потом npm test . Да, это неудобно. В случае юнит-тестов этого делать не нужно, так как они запускаются под Node и не требуют трансляции и сборки.
Для полноты картины давайте взглянем на webpack.config.js , где описано, как Webpack должен делать сборку файлов:
Module.exports = { entry: "./lib/app.js", output: { filename: "bundle.js", path: path.resolve(__dirname, "dist") }, ... }
Папка dist используется как в пользовательском окружении, так и в E2E-тестах. Это важно - запускать E2E-тесты нужно в средах, максимально похожих на «боевые».
Настройка браузера в Mocha
Наше приложение установлено на сервер - осталось лишь запустить для него браузер. Какую библиотеку мы будем использовать для автоматизации? Я обычно использую популярную selenium-webdriver .
Для начала давайте посмотрим, как мы используем её, прежде чем начнём разбираться с настройками:
Const {prepareDriver, cleanupDriver} = require("../utils/browser-automation") //... describe("calculator app", function () { let driver ... before(async () => { driver = await prepareDriver() }) after(() => cleanupDriver(driver)) it("should work", async function () { await driver.get("http://localhost:8080") //... }) })
В функции before мы готовим драйвер, а в after - очищаем его. Подготовка драйвера будет запускать браузер, а очистка - закрывать его. Заметим, что настройка драйвера происходит асинхронно и мы можем использовать async/await , чтобы сделать код красивее.
В тестовой функции мы открываем адрес http://localhost:8080 , снова используя await , учитывая, что driver.get - асинхронная функция.
Так как же выглядят prepareDriver и cleanupDriver ?
Const webdriver = require("selenium-webdriver") const chromeDriver = require("chromedriver") const path = require("path") const chromeDriverPathAddition = `:${path.dirname(chromeDriver.path)}` exports.prepareDriver = async () => { process.on("beforeExit", () => this.browser && this.browser.quit()) process.env.PATH += chromeDriverPathAddition return await new webdriver.Builder() .disableEnvironmentOverrides() .forBrowser("chrome") .setLoggingPrefs({browser: "ALL", driver: "ALL"}) .build() } exports.cleanupDriver = async (driver) => { if (driver) { driver.quit() } process.env.PATH = process.env.PATH.replace(chromeDriverPathAddition, "") }
Это сложная штука. И я должен кое-что признать: этот код был написан кровью (о, и он работает только в Unix-системах). Он был написан при помощи Google, Stack Overflow и документации webdriver и сильно модифицирован методом научного тыка. Но он работает!
Теоретически вы можете просто скопипастить код в свои тесты, не разбираясь в нём, но давайте заглянем в него на секунду.
Первые две строки подключают webdriver - драйвер для браузера. Принцип работы Selenium Webdriver заключается в наличии API (в модуле selenium-webdriver , который мы импортируем в строке 1), который работает с любым браузером, и он полагается на драйверы браузера, чтобы… управлять различными браузерами. Драйвер, который я использовал, - chromedriver , импортированный в строке 2.
Драйвер Chrome не нуждается в браузере на машине: он фактически устанавливает свой собственный исполняемый файл Chrome, когда вы выполняете npm install . К сожалению, по некоторым причинам, которые я не могу понять, он не может найти его, и каталог chromedriver должен быть добавлен в PATH (это именно то, что не работает в Windows). Это мы делаем в строке 9. Мы также удаляем его из PATH на этапе очистки, в строке 22.
Итак, мы настроили драйвер браузера. Теперь пришло время настроить (и вернуть) веб-драйвер, что мы и делаем в строках 11–15. А поскольку функция build асинхронна и возвращает , мы ждём её при помощи await .
Почему мы делаем это в строках 11–15? Причины скрыты туманом опыта. Не стесняйтесь копипастить - никаких гарантий не прилагается, но я использовал этот код некоторое время, и проблем не возникало.
Приступим к тестам
Мы закончили настройку - пришло время взглянуть на код, который использует webdriver для управления браузером и тестирования нашего кода.
Диско-диффузионный метод
На поверхность плотной питательной среды, засеянной сплошным газоном исследуемой культурой, накладывают не более 6 дисков, пропитанных антибиотиками, на расстоянии не менее 2 см друг от друга. Регистрация результатов проводится через 18-24 часов инкубирования в термостате по диаметру зоны отсутствия роста вокруг дисков с антибиотиками. Наличие роста вокруг диска свидетельствует о нечувствительности данного микроба к антибиотику. Для интерпретации результатов используются специальные таблицы.
Рисунок 1. Определение чувствительности
микроорганизмов диско-диффузионным методом:
1 – микроорганизм чувствителен к антибиотику;
2 – микроорганизм умеренно резистентен к антибиотику;
3 – микроорганизм устойчив к антибиотику.
Метод Е-тестов
Принцип метода. Определение чувствительности микроорганизма проводится аналогично тестированию диско-диффузионным методом. Отличие состоит в том, что вместо диска с антибиотиком используют полоску Е-теста, содержащую градиент концентраций антибиотика от максимальной к минимальной. В месте пересечения эллипсовидной зоны подавления роста с полоской Е-теста получают значение минимальной подавляющей концентрации (МПК).

Рисунок 2. Определение чувствительности микроорганизмов с помощью Е-тестов
Метод серийных разведений в бульонной среде
В пробирках, содержащих 1 мл Мюллер-Хинтон бульона, готовят серийные двукратные разведения антибактериального препарата, например 100 мкг/мл – 1-я, 50 мкг/мл – 2-я, 25 мкг/мл – 3-я, 12,5 мкг/мл – 4-я и т.д. Затем в каждую пробирку вносят 0,1 мл испытуемой бактериальной суспензии. Одновременно ставят контроль роста (1 мл Мюллер-Хинтон бульона и 0,1 мл суспензии бактерий). Посевы инкубируют при 37°С в течение 18-24 ч., после чего отмечают результаты. Отсутствие помутнения среды свидетельствует о задержке роста бактерий в присутствии данной концентрации препарата.

Рисунок 3. Определение значения МПК методом разведения в жидкой питательной среде
Минимальная подавляющая концентрация (МПК) – наименьшая концентрация антибиотика (в мкг/мл или мг/л), которая in vitro полностью подавляет видимый рост бактерий.
2 Определение чувствительности разных штаммов стафилококков к антибиотикам методом стандартных дисков
|
Антибиотик |
Зона подавления роста, мм |
Характеристика штамма |
Исследуемая культура является чувствительной к __________________________________________________
умеренно устойчивой к _________________________________________________________________________,
устойчивой к _________________________________________________________________________________.
3 Определение минимальной подавляющей концентрации (МПК) пенициллина методом серийных разведений.
Вывод: МПК пенициллина для исследуемого штамма составляет _____________________________________
Достоинства метода:____________________________________________________________________________
Недостатки метода:____________________________________________________________________________
4 Выявление и регистрация антагонистического действия разных видов бактерий.
На чашку с МПА штрихом по диаметру засевается микроб-антагонист и перпендикулярно к нему тест-штаммы. Учет результатов проводится через сутки после посева. Наличие и степень антагонистического действия определяют по величине зон задержки роста тест-культур.
Штриховой посев________________________
Вывод: наибольшее антагонистическое действие выявлено к тест-штаммам (укажите виды) _____________________________________________________________________________________________
ЗАНЯТИЕ № 8
ТЕМА: ИТОГОВОЕ ЗАНЯТИЕ ПО ТЕМЕ: «ИСТОРИЧЕСКИЕ ЭТАПЫ РАЗВИТИЯ МИКРОБИОЛОГИИ, МОРФОЛОГИЯ, ФИЗИОЛОГИЯ И ГЕНЕТИКА МИКРООРГАНИЗМОВ».
Формы и размеры истинных бактерий. Характеристика шарообразных, палочковидных и извитых форм истинных бактерий.
Структура бактерий. Основные отличия прокариотной клетки от эукариот.
Клеточная стенка грамположительных и грамотрицательных бактерий.
Типы микроскопических препаратов. Техника приготовления фиксированных препаратов.
Техника микроскопии в световом микроскопе. Изучение морфологии микроорганизмов в электронном микроскопе.
Тинкториальные свойства микробов. Красители. Простые способы окраски фиксированных препаратов.
Принципы классификации патогенных прокариот (Берджи, 2001).
Защитные приспособления у микроорганизмов. Споры, стадии и условия образования спор, биологическое значение.
Капсулы бактерий, их значение.
Жгутики, их строение. Реснички. Секс-пили.
Сложные способы окраски. Техника окраски по Граму, Цилю-Нельсену, Бурри-Гинсу, Нейссеру.
Методы исследования микроорганизмов в живом состоянии. КОН-тест. Принцип метода.
Спирохеты. Систематическое положение и морфология спирохет. Особенности ультраструктуры и химического состава. Методы исследования.
Актиномицеты, морфология, ультраструктура, химический состав. Патогенные виды. Роль актиномицетов в природе и медицине. Методы выявления.
Таксономия хламидий. Морфология, структура, способы выявления. Цикл развития хламидий.
Риккетсии, морфология, ультраструктура, химический состав. Патогенные виды.
Микоплазмы. Классификация. Филогенез. Способы выявления.
Дефектные формы микробов: протопласты, сферопласты, L-формы.
Питание бактерий. Питательные вещества – источники углерода и азота. Классификация бактерий по типам питания Аутотрофы и хемоорганотрофы
Факторы роста и их источники. Источники минеральных элементов.
Способы и механизмы переноса питательных веществ через мембрану.
Энергетические потребности бактерий. Пути получения энергии у аутотрофов (фотосинтез, хемосинтез). Источники и пути получения энергии у хемоорганотрофов.
Аэробный и анаэробный типы биологического окисления у бактерий. Аэробные, анаэробные, факультативно анаэробные и микроаэрофильные бактерии. Способы создания анаэробных условий.
Задачи, этапы, преимущества и недостатки бактериологического (культурального) метода исследования.
Рост и размножение микроорганизмов. Способы размножения. Бинарное (простое) деление, механизм. Размножение бактериальных популяций.
Принципы и методы культивирования бактерий. Питательные потребности микробов.
Питательные среды для культивирования бактерий. Требования к питательным средам. Классификация питательных сред.
Условия и техника культивирования бактерий. Техника посева на питательные среды. Закономерности и характер роста бактерий на плотных и жидких питательных средах.
Способы выделения чистых культур аэробных и анаэробных бактерий.
Свойства микроорганизмов, используемые для идентификации выделенных культур.
Ферменты бактерий, классификация. Способы изучения биохимических свойств микроорганизмов. Практическое использование биохимической активности в идентификации бактерий
Определение сахаролитических свойств, состав сред Гисса; определение протеолитических свойств, определение каталазной и оксидазной активности.
Принцип работы и особенности применения приборов автоматической идентификации бактериальных культур (гемокультиватор, автоматический анализатор).
Особенности культивирования риккетсий и хламидий.
Бактериофаги (фаги). История открытия. Морфология, структурные особенности, химический состав и свойства фагов.
Вирулентные фаги. Фазы взаимодействия с бактериальной клеткой. Результаты взаимодействия фага и клетки. Умеренные фаги. Профаг. Явление лизогении. Фаговая конверсия.
Методы выделения и титрования бактериофагов на плотных и жидких питательных средах.Применение фагов в микробиологии и медицине. Фагодиагностика и фаготипирование.
Наследственность. Организация генетического аппарата у бактерий (нуклеоид, плазмиды, Is -последовательности, транспозоны).
Принципы функционирования бактериального генома. Организация оперона. Генотип и фенотип.
Плазмиды, классификация, структура и свойства плазмид. R-плазмида, особенности структуры и функции. Плазмиды бактериоциногении.
Изменчивость микробов. Модификации у бактерий, значение, основные проявления и свойства (ненаследственный характер, адаптивность, высокая частота прямых и обратных изменений, множество индуцирующих факторов).
Генотипическая изменчивость. Мутации и их классификация. Мутагены. Фенотипические проявления мутаций. Судьба мутантов. Диссоциация у бактерий. Влияние отбора. Система репарации повреждений генома.
Рекомбинационная изменчивость. Механизмы образования комбинированных геномов. Частота изменений отдельных признаков. Трансформация, трансдукция, конъюгация.
Практическое значение знаний о генетике микробов. Принципы генетического картирования.
Методы генетического анализа (молекулярная гибридизация, полимеразная цепная реакция, блотинг, секвенирование).
Понятие о генной инженерии и использование ее методов в микробиологии и биотехнологии. Получение и применение генно-инженерных вакцин и цитокинов.
Противомикробные мероприятия. Влияние экологических факторов на микробы. Действие физических факторов (температуры, высушивания, излучений, ультразвука, осмотического давления). Действие химических факторов.
Цели, способы, средства и объекты стерилизации и дезинфекции в медицинской и микробиологической практике. Контроль качества дезинфекции. Контроль стерилизации и стерильности. Способы проведения.
Антисептика. Определение. Антисептические средства, требования, происхождение, свойства, группы, механизмы действия на микробы. Типы антисептики. Терапевтическая антисептика. Профилактическая антисептика.
Химиотерапевтические препараты. Свойства. Основные группы химиопрепаратов. Механизмы действия на бактерии. Понятие об избирательности и "мишенях" действия.
Антибиотики. Определение. Продуценты антибиотиков. Синтетические и полусинтетические антибиотики.
Основные группы антибиотиков по химической структуре. Бета-лактамные антибиотики Тетрациклины. Аминогликозиды. Макролиды и азолиды. Анзамицины (рифампицины). Левомицетин. Фторхинолоновые антибиотики. Линкомицин. Полимиксины. Гликопептиды
Классификация антибиотиков про механизму действия на бактериальную клетку.
Механизмы устойчивости микроорганизмов к антибактериальным препаратам.
Методы определения чувствительности бактерий к антибиотикам и другим химиопрепаратам. Техника постановки, учета и оценки чувствительности методом дисков, Е-теста, серийных разведений.
ЗАНЯТИЕ № 9
ТЕМА: ЭКОЛОГИЯ БАКТЕРИЙ. ИНФЕКЦИЯ. ПАТОГЕННЫЕ МИКРООРГАНИЗМЫ. ТОКСИНЫ МИКРОБОВ. БИОЛОГИЧЕСКИЙ (ЭКСПЕРИМЕНТАЛЬНЫЙ) МЕТОД.
ПЕРЕЧЕНЬ КОНТРОЛЬНЫХ ВОПРОСОВ
Микрофлора тела человека. Нормальная (резидентная) микрофлора человека. Аутохтонная и аллохтонная, пристеночная и просветная микрофлора. Формирование и развитие нормальной микрофлоры. Функции нормальной микрофлоры: противоинфекционная, метаболическая, иммунобиологическая, антитоксическая.
Дисмикробиоценоз (дисбактериоз), причины, виды, принципы коррекции.
Понятие об инфекции. Определение, общая характеристика. Отличия инфекционных болезней от неинфекционных.
Роль микроорганизма в инфекционном процессе. Инфицирующая доза. Способы заражения. Входные ворота. Патогенность и вирулентность. Генетический контроль патогенности и вирулентности. Факторы, повышающие и снижающие вирулентность микробов.
Факторы патогенности. Методы определения вирулентности, единицы. Облигатно-патогенные и условно-патогенные микроорганизмы.
Токсичность и токсигенность микроорганизмов. Эндотоксины, свойства, получение, применение. Экзотоксины, свойства, получение, единицы измерения. Типы экзотоксинов, механизм действия.
Роль макроорганизма в развитии и течении инфекционных болезней. Наследственные факторы. Анатомо-физиологическое состояние организма. Роль условий жизни в развитии и течении инфекционных болезней. Природные факторы. Социальные факторы.
Классификация инфекционных процессов по тяжести, характеру возбудителя, по источнику инфекции, способу передачи возбудителя и механизму заражения, по распространенности. Классификация инфекционных процессов по локализации микробного очага, длительности течения и кратности заражения.
Динамика инфекционного процесса, его особенности.
Биологический (экспериментальный) метод исследования, этапы, оценка. Лабораторные животные. Способы заражения.
ЛАБОРАТОРНАЯ РАБОТА
1 Изучения нормальной микрофлоры.
А) Посев для изучения нормальной микрофлоры кожи рук на среду Эндо и кровяной агар методом реплик .
Принцип метода: стерильные кусочки фильтровальной бумаги 1х1 см в чашке Петри увлажнить стерильным физ. раствором. Стерильным пинцетом поместить кусочек бумаги на исследуемую поверхность кожи рук на 0,5 мин. Поместить бумагу на поверхность плотной питательной среды (отпечаток) на 1 мин. Бумагу удалить. Чашки с отпечатками инкубировать при 37 0 С, 24-48 часов.
В) Провести учет посева микрофлоры, приготовить препараты из разных типов колоний, окрасить по Граму, микроскопировать (в демонстрационных посевах).
Учет посева микрофлоры:
Микроскопия препаратов:
|
Препарат______________ _______________________ Окраска _______________ _______________________ |
Препарат______________ _______________________ Окраска _______________ _______________________ |
2 Оценка адгезивности E . coli по их способности к адсорбции на поверхности эритроцитов
Принцип метода: К суспензии эритроцитов добавляют испытуемую культуру микроорганизмов. После инкубации готовят мазки, окрашивают и под микроскопом определяют среднее количество бактерий, адсорбировавшихся на одном эритроците.
Эритроциты в данном случае используются в качестве модели клетки восприимчивого микроорганизма.
3 Определение ферментов инвазивности у стафилококков
1. Плазмокоагулаза
Принцип метода: В пробирку, содержащую цитратную плазму крови кролика, вносится испытуемая культура. После инкубации в термостате учитывается результат. При положительном результате плазма свертывается (коагулирует).
2. Фибринолизин
Принцип метода: В пробирку с фибрином (отмытый от эритроцитов сгусток крови) вносят испытуемую культуру. После инкубации в термостате учитывается результат. При положительном результате сгусток растворяется.
3. Гиалуронидаза
Принцип метода: В пробирку с гиалуроновой кислотой (ГУК) вносят испытуемую культуру. После инкубации в термостате добавляют реактив, вызывающий свертывание ГУК и учитывают результат. При положительном результате (вследствие расщепления ГУК) сгустка не образуется.
4. Лецитовителлаза (лецитиназа)
Принцип метода: выделенные культуры стафилококка засевают на желточно-солевой агар, который содержит 7,5% хлорида натрия и желточную суспензию. При положительном результате вокруг колоний вирулентных стафилококков образуется радужный ореол вследствие расщепления лецитина, содержащегося в желтке куриного яйца.
Вывод: (перечислите ферменты вирулентности каждого из двух изученных штаммов) _____________________________________________________________________________________________
_____________________________________________________________________________________________
Бактериальные токсины
Токсичность __________________________________________________________________________________
Токсигенность _________________________________________________________________________________
Эндотоксин ___________________________________________________________________________________
Эндотоксический шок ___________________________________________________________________________
Практическое применение эндотоксинов:
Экзотоксин ___________________________________________________________________________________
Анатоксин ____________________________________________________________________________________
Схема получения экзотоксина и анатоксина.
1.____________________________________________________________________________________________
2.____________________________________________________________________________________________
4.____________________________________________________________________________________________
Практическое применение анатоксинов:
1.____________________________________________________________________________________________
2.____________________________________________________________________________________________
3.____________________________________________________________________________________________
Оглавление темы "Методы определения чувствительности к антимикробным средствам. Побочные эффекты антибиотикотерапии.":Новые методы определения чувствительности бактерий к химиопрепаратам. Автоматические системы учёта результатов метода серийных разведений. Е-тест.
В настоящее время разработаны компьютеризованные системы , автоматически проводящие выделение бактерий из исследуемых образцов и определяющие их чувствительность к различным ЛС. Их основное достоинство - освобождение персонала бактериологических лабораторий от большого объёма рутинных исследований и чёткая стандартизация полученных результатов.
Широкое распространение этих устройств в отечественной практике ограничивает их стоимость. Среди более доступных методов наибольшее распространение нашли система Alamar и Е-тест , совмещающие в себе достоинства метода серийных разведений и метода дисков.
Новые методы определения чувствительности бактерий к химиопрепаратам. Автоматические системы учёта результатов метода серийных разведений">
Автоматические системы учёта результатов метода серийных разведений (например, Baxter MicroScan AutoSCAN-4) - автоматизированные инкубационные системы со встроенными фотометрами, нефелометрически регистрирующими рост бактерий или его отсутствие через 24 ч после внесения микроорганизмов в лунки микропанелей. Принцип действия основан на учете разницы оптической плотности среды в лунках, где есть рост бактерий, и в лунках, где его нет. В настоящее время разработаны устройства (например, VITEK), позволяющие получить результаты уже через 4-10 ч.
Система Alamar представляет собой панель с лунками, в каждую помещены диски из фильтровальной бумаги, содержащие различные концентрации антимикробных препаратов и пропитанные индикатором Alamar Blue. После внесения в лунку бактерий диск синеет, а при их дальнейшем росте его окраска меняется на розовую. Порядок размещения дисков в лунках соответствует двойным серийным разведениям препарата. Последняя лунка с синим диском, предшествующая лункам с порозовевшими дисками, соответствует МИК препарата.
Е-тест [от англ. ellipse, эллипс, так как при наличии чувствительности образуется зона задержки роста эллиптической формы] - модификация метода дисков, но вместо последних используют полоски из фильтровальной бумаги, пропитанной различными концентрациями препаратов, каждая из этих зон имеет соответствующую маркировку. Полоски помещают на поверхность агара. Если бактерии чувствительны к действию препарата, вокруг участков полоски, содержащих его ингибирующие концентрации, образуется эллипсовидная зона. Её форма обусловлена действием сразу нескольких концентраций препарата. МИК соответствует участок полоски, где её пересекает граница зоны задержки роста.